필라델피아 염색체
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
필라델피아 염색체는 1959년 발견된, 22번 염색체가 짧아진 형태의 비정상적인 염색체로, 주로 9번과 22번 염색체의 전좌 t(9;22)(q34;q11)에 의해 생성되는 BCR-ABL1 융합 유전자를 특징으로 한다. 이 융합 유전자는 티로신 키나아제 활성을 증가시켜 세포 분열을 조절하지 못하게 하고 만성 골수성 백혈병(CML)과 급성 림프구성 백혈병(ALL)을 유발한다. 이마티닙과 같은 티로신 키나제 억제제가 치료에 사용되며, 약제 내성이나 불응성인 경우 조혈모세포 이식을 고려한다.
더 읽어볼만한 페이지
| 필라델피아 염색체 | |
|---|---|
| 일반 정보 | |
 | |
| 발견 연도 | 1960년 |
| 발견자 | 피터 노웰과 데이비드 헝거포드 |
| 관련 질병 | 만성 골수성 백혈병 (CML)의 95% 급성 림프구성 백혈병 (ALL)의 25-30% (성인), 2-10% (어린이) 드물게 급성 골수성 백혈병 (AML) 드물게 골수형성이상증후군 (MDS) 드물게 만성 호산구성 백혈병 |
| 유전학 | |
| 유전자 위치 | 염색체 9와 22 |
| 유전자 | ABL1 (9번 염색체) BCR (22번 염색체) |
| 돌연변이 | 염색체 전좌 t(9;22)(q34;q11) |
| 결과 | BCR-ABL 융합 유전자 생성 |
| 병태생리학 | |
| 메커니즘 | 티로신 키나아제 활성 증가 |
| 영향 | 세포 증식 증가 세포 사멸 억제 유전적 불안정성 증가 |
| 진단 | |
| 방법 | 세포유전학적 분석 FISH (Fluorescence In Situ Hybridization) PCR (Polymerase Chain Reaction) |
| 치료 | |
| 표적 치료제 | 티로신 키나아제 억제제 (TKI) |
| 예시 | 이마티닙 다사티닙 닐로티닙 보수티닙 포나티닙 |
| 기타 | |
| 관련 용어 | BCR-ABL 필라델피아 염색체 양성 백혈병 |
2. 분자생물학적 특징
필라델피아 염색체는 9번 염색체와 22번 염색체의 일부가 서로 자리를 바꾸는 전좌 현상으로 인해 생성된다. 이 과정에서 9번 염색체의 ''ABL1'' 유전자와 22번 염색체의 ''BCR'' 유전자가 결합하여 ''BCR-ABL1'' 융합 유전자가 만들어진다.[4][5] 이 융합 유전자는 티로신 키나아제 활성을 가지는 BCR-ABL1 융합 단백질을 생성하는데, 이 단백질은 세포 분열을 촉진하고 DNA 복구를 억제하여 암을 유발한다.
2. 1. 염색체 전좌
필라델피아 염색체의 염색체 결함은 9번 염색체와 22번 염색체의 일부가 서로 자리를 바꾸는 상호 전좌 현상이다. 국제 인간 세포유전학 명명법(ISCN)에 따르면 이 염색체 전좌는 t(9;22)(q34;q11)로 표시된다.[4][5]
이 전좌의 결과, 9번 염색체의 q34 영역에 있는 ''ABL1'' 유전자가 22번 염색체의 q11 영역에 있는 ''BCR''(breakpoint cluster region) 유전자의 일부와 결합하여 융합 유전자가 만들어진다. 이 과정에서 길어진 9번 염색체(der 9)와 짧아진 22번 염색체(필라델피아 염색체, 22q-)가 생성된다.[4][5]
짧아진 22번 염색체에서는 종양 유전자인 ''BCR-ABL1'' 융합 유전자가 발견된다. 이 유전자는 BCR-ABL1 융합 단백질을 만드는데, 융합 위치에 따라 분자량이 185~210 kDa 사이인 p210 또는 p185 단백질이 생성된다.
융합 유전자에 의해 만들어지는 주요 변이체는 p190, p210, p230의 세 가지이다.[7] p190은 주로 B 세포 급성 림프구성 백혈병(ALL)과 관련이 있고, p210은 주로 만성 골수성 백혈병과 관련이 있지만 ALL 및 AML과도 관련될 수 있다.[8] p230은 대개 호중구 증가증 및 혈소판 증가증을 동반하는 만성 골수성 백혈병(CML-N)과 관련된다.[8] p190은 p210의 스플라이스 변이체로 발현될 수도 있다.[9]
''BCR-ABL1'' 전사체는 ''BCR''과 ''ABL1'' 유전자 모두의 도메인을 포함하는 티로신 키나아제로 번역된다. 일반적으로 티로신 키나아제 활성은 자동 억제 방식으로 조절되지만, ''BCR-ABL1'' 융합 유전자는 항상 활성화된 단백질을 만들어 DNA 결합 장애와 조절되지 않는 세포 분열, 즉 암을 유발한다.[10] BCR 영역은 세린/트레오닌 키나아제를 발현하지만, 티로신 키나아제 기능은 약물 치료의 주요 대상이다. 티로신 키나아제 억제제(이마티닙, 수니티닙 등)는 BCR-ABL1 키나아제 활성을 억제하여 CML, 신장 세포 암종(RCC), 위장관 기질 종양(GIST) 등 다양한 암 치료에 사용된다.
BCR-ABL1 단백질은 인터루킨-3 수용체 베타(c) 서브유닛과 상호작용하며, ATP에 결합하면 활성화되는 SH1 도메인 내의 활성화 루프에 의해 조절된다. BCR-ABL1의 ABL1 티로신 키나아제 활성은 정상 ABL1보다 증가되어 있다.[11] ABL은 여러 세포 주기 조절 단백질 및 효소를 활성화하므로, BCR-ABL1 융합은 세포 분열 속도를 빠르게 한다. 또한, DNA 복구를 억제하여 유전체 불안정성을 유발하고, CML의 폭발기를 일으킬 수 있다.
2. 2. BCR-ABL1 융합 유전자
필라델피아 염색체의 염색체 결함은 9번 염색체와 22번 염색체의 일부가 자리를 바꾸는 상호 전좌 현상이다. 9번 염색체(q34 영역)의 ''ABL1'' 유전자가 22번 염색체(q11 영역)의 ''BCR''(breakpoint cluster region) 유전자의 일부와 이어져 융합 유전자가 생성된다. 국제 인간 세포유전학 명명법(ISCN)에 따르면, 이 염색체 전좌는 t(9;22)(q34;q11)로 표시된다.[4][5]
이 전좌로 인해 ''BCR-ABL1'' 종양 유전자 융합이 발생하며, 이는 BCR-ABL1 융합 단백질을 암호화한다. 융합 위치에 따라 이 단백질의 분자량은 185~210 kDa 범위일 수 있으며, p190, p210, p230 등 세 가지 주요 변이체가 존재한다.[7] p190은 주로 B 세포 급성 림프구성 백혈병(ALL)과 관련되며, p210은 주로 만성 골수성 백혈병(CML)과 관련되지만 ALL, AML과도 관련될 수 있다.[8] p230은 호중구 증가증 및 혈소판 증가증을 동반하는 만성 골수성 백혈병(CML-N)과 관련된다.[8] p190은 p210의 스플라이스 변이체로 발현될 수도 있다.[9]
''BCR-ABL1'' 전사체는 ''BCR'' 및 ''ABL1'' 유전자 모두의 도메인을 포함하는 티로신 키나아제로 번역된다. ''BCR-ABL1'' 융합 유전자는 "항상 활성화된" 단백질을 암호화하여 DNA 결합 장애와 조절되지 않은 세포 분열(즉, 암)을 유발한다. 이는 티로신 키나아제의 활성이 정상적으로는 자동 억제 방식으로 조절되지만, 미리스토일화 캡 영역(존재하는 경우 키나아제 도메인을 비활성화하는 구조 변화를 유도함)이 BCR 단백질의 절단된 부분으로 대체되기 때문이다.[10] BCR 영역은 세린/트레오닌 키나아제를 발현하지만, 티로신 키나아제 기능은 약물 치료에 매우 중요하다. BCR의 N-말단 Y177 및 CC 도메인이 ABL1 키나아제의 구성적 활성화를 암호화하므로, 이러한 영역은 BCR-ABL1 키나아제 활성을 하향 조절하는 치료법의 표적이 된다. CC, Y177 및 Rho와 같은 도메인에 특이적인 티로신 키나아제 억제제(이마티닙 및 수니티닙)는 CML, 신장 세포 암종(RCC) 및 위장관 기질 종양(GIST)을 포함한 다양한 암에 대한 중요한 약물이다.
융합된 BCR-ABL1 단백질은 인터루킨-3 수용체 베타(c) 서브유닛과 상호 작용하며, ATP에 결합하면 "켜지고" 하류 경로를 활성화하는 SH1 도메인 내의 활성화 루프에 의해 조절된다. BCR-ABL1의 ABL1 티로신 키나아제 활성은 야생형 ABL1에 비해 증가한다.[11] ABL은 여러 세포 주기 조절 단백질 및 효소를 활성화하므로, BCR-ABL1 융합의 결과는 세포 분열 속도가 빨라진다. 또한, DNA 복구를 억제하여 유전체 불안정성을 유발하고, CML에서 두려워하는 폭발기를 일으킬 수 있다.
2. 3. 티로신 키나아제 활성
BCR-ABL1 융합 단백질의 티로신 키나아제 활성은 정상 ABL1 단백질보다 증가되어 있다.[11] ABL은 여러 세포 주기 조절 단백질 및 효소를 활성화하므로, BCR-ABL1 융합이 일어나면 세포 분열 속도가 빨라진다. 또한, DNA 복구를 억제하여 유전체 불안정성을 유발하고, 만성 골수성 백혈병에서 문제가 되는 폭발기를 일으킬 수 있다. BCR 영역의 N-말단 Y177 및 CC 도메인이 ABL1 키나아제의 구성적 활성화에 중요한 역할을 한다.3. 백혈병에서의 증식 역할
필라델피아 염색체로 인해 생성되는 BCR-ABL1 융합 유전자와 단백질은 세포자멸사, 세포 분열 속도, 세포 주기의 여러 단계에 직접 영향을 주는 다양한 신호 전달 경로에 관여한다. 이를 통해 만성 골수성 백혈병(CML)과 급성 림프구성 백혈병(ALL)에서 특징적으로 나타나는 무제한적인 세포 증식이 일어난다.[12]
3. 1. JAK/STAT 경로
JAK/STAT 경로는 사이토카인 수용체와 성장 인자를 조절할 수 있는 전사 인자인 STAT를 활성화한다. JAK2는 Y177에서 BCR-ABL 융합 단백질을 인산화하여 융합 단백질을 안정화시키고 종양 발생 세포 신호 전달을 강화한다.[12] JAK2 돌연변이는 골수 증식성 신생물에 중추적인 역할을 하는 것으로 나타났으며, JAK 키나제는 혈액 악성 종양을 유발하는 데 중추적인 역할을 한다.[12] 닐로티닙과 룩솔리티닙을 사용한 마우스 모델 실험에서 STAT3 및 STAT5 전사 활성화를 억제함으로써 하위 사이토카인 신호 전달을 다운레귤레이션하는 BCR-ABL뿐만 아니라 JAK2도 표적으로 삼았다.[12] 이러한 조혈 악성 종양 내에서 JAK2와 BCR-ABL의 상호 작용은 Ph 염색체와 BCR-ABL 티로신 키나제 활성을 나타내는 백혈병 세포의 성장을 촉진하는 데 JAK-STAT 매개 사이토카인 신호 전달의 중요한 역할을 시사한다.[12][13] CML에서 직접 증식에 대한 JAK2 경로의 중심성에 대해서는 논쟁이 있었지만, BCR-ABL 티로신 키나제의 하위 효과기로서의 역할은 유지되어 왔다.[13] JAK-STAT을 통한 세포 주기의 영향은 대부분 주변적이지만, 조혈 니치와 그 주변 미세 환경의 유지를 직접적으로 영향을 미침으로써, BCR-ABL에 의한 JAK-STAT 신호 전달의 상향 조절은 백혈병 세포의 성장과 분열을 유지하는 데 중요한 역할을 한다.[12][13]3. 2. Ras/MAPK/ERK 경로
Ras/MAPK/ERK 경로는 신호를 핵 전사 인자에 전달하고 세포 주기 조절 및 분화를 조절하는 역할을 한다. 필라델피아 염색체를 포함하는 세포에서 BCR-ABL 티로신 키나제는 RAS/RAF/MEK/ERK 경로를 활성화시키는데, 이는 핵 내 유전자 전사를 통한 조절되지 않은 세포 증식을 초래한다. BCR-ABL 티로신 키나제는 Y177의 BCR 위치 인산화에 의존적인 GAB2 단백질의 인산화를 통해 Ras를 활성화시킨다.[14]특히 Ras는 만성 골수성 백혈병(CML)에서 BCR-ABL1의 중요한 하위 표적임이 입증되었는데, 마우스 모델에서 Ras 돌연변이는 BCR-ABL1 유전자와 관련된 CML의 발생을 방해한다. Ras/RAF/MEK/ERK 경로는 또한 조혈 줄기세포 유지에 중요한 오스테오폰틴(OPN)의 과발현과 관련이 있으며, 이는 백혈병 세포의 특징인 제어되지 않은 증식에 간접적으로 영향을 미친다.[14] BCR-ABL 융합 세포는 GTP에 결합된 활성화된 Ras의 구성적으로 높은 수준을 나타내는데, 이는 BCR-ABL 하위에서 세포자멸사를 억제하는 것으로 나타난 Ras 의존성 신호 전달 경로를 활성화시킨다.[15][16][17] IL-3 수용체와의 상호 작용은 또한 Ras/RAF/MEK/ERK 경로를 유도하여 세포주기의 G1/S 전이를 유도하는 역할을 하는 전사 인자를 인산화시킨다.
3. 3. DNA 결합 및 세포자멸사
정상 세포에서 c-Abl 유전자는 DNA 결합에 관여하며, 이는 DNA 전사, 복구, 세포자멸사 및 세포 주기의 기반이 되는 다른 과정들에 영향을 미친다. 이러한 상호작용의 본질에 대해서는 논의가 있었지만, DNA 손상에 반응하여 c-Abl이 세린/트레오닌 키나제인 HIPK2를 인산화하고 정상 세포에서 세포자멸사를 촉진한다는 것을 시사하는 증거가 있다. 반대로, BCR-ABL 융합 유전자는 세포자멸사를 억제하는 것으로 나타났지만, 특히 DNA 결합에 대한 영향은 불분명하다.[18]BCR-ABL 세포는 약물 유도 세포자멸사에 저항성을 보이지만, p53, p21 및 Bax의 발현 수준 증가로 인해 세포자멸사 촉진 발현 프로필을 가진다. 그러나 이러한 세포자멸사 촉진 단백질의 기능은 손상되어 세포자멸사가 일어나지 않는다. BCR-ABL은 또한 caspase 9 및 caspase 3 처리를 억제하여 억제 효과를 더한다.[19][20] 세포 주기 진행과 세포자멸사를 억제하는 또 다른 요인은 IKAROS 유전자의 결실인데, 이는 Ph 염색체 양성 ALL 사례의 80% 이상에서 나타난다. IKAROS 유전자는 Ph 양성 ALL 세포에서 pre-B 세포 수용체 매개 세포 주기 정지에 중요하며, 손상되면 BCR-ABL 티로신 키나제 신호에 의해 촉진되는 것처럼 결함 세포의 무제한 세포 주기 진행 및 증식을 위한 메커니즘을 제공한다.[21]
4. 명명법
필라델피아 염색체는 '''Ph(또는 Ph') 염색체'''로 불리며, BCR-ABL 융합 유전자/단백질 키나제를 암호화하는 짧아진 22번 염색체를 나타낸다. 이는 9번 염색체와 22번 염색체 사이에서 발생하는 전좌, 즉 '''t(9;22)(q34.1;q11.2)'''로 인해 발생하며, 9번 염색체 장완(q)의 3영역, 4대역, 1소대역과 22번 염색체 장완(q)의 1영역, 1대역, 2소대역에서 절단이 일어난다. 따라서 ISCN 표준을 사용하여 염색체 절단점은 각각 (9q34.1)과 (22q11.2)로 표기된다.
5. 치료
필라델피아 염색체 양성 백혈병의 치료는 주로 티로신 키나아제 억제제(TKI)를 사용한다.
이 염색체에 의해 생성되는 효소(abl-bcr 티로신 키나아제)의 기능을 특이적으로 억제하는 표적항암제가 개발되고 있다. 그 선두 주자로 만성 골수성 백혈병 치료에 큰 진전을 가져온 것이 이마티닙(상품명: 글리벡)이다.
표준 항암 화학 요법과 RTK 억제제를 병용하여 소아 Ph+ ALL을 치료하면 관해가 될 수 있지만, 치료 가능성은 알 수 없다.
5. 1. 티로신 키나아제 억제제(TKI)
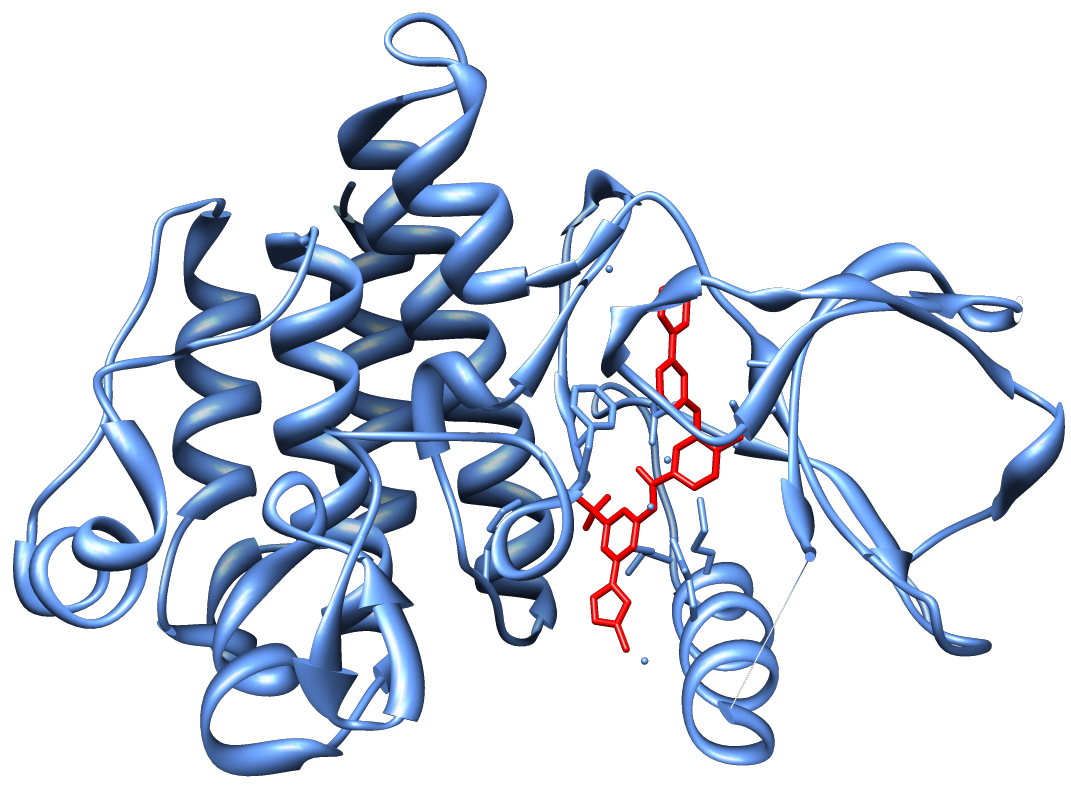
1990년대 후반, 제약회사 노바티스는 티로신 키나제 억제제(TKI)에 대한 고처리량 스크리닝에서 STI-571(이마티닙, 글리벡/글리벡)을 확인했다. 오레곤 보건과학대학교의 브라이언 J. 드루커 박사가 찰스 소이어스 박사와 모세 탈파즈 박사와 공동으로 진행한 후속 임상 시험에서 STI-571이 BCR-ABL을 발현하는 조혈 세포의 증식을 억제하는 것으로 나타났다. CML 세포를 근절하지는 못했지만 종양 클론의 성장을 크게 제한하고 "백혈병 위기"의 위험을 감소시켰다.
2000년 존 쿠리안 박사는 STI-571이 Abl 키나제 도메인을 억제하는 메커니즘을 밝혀냈다.[22] 2001년 노바티스는 이마티닙 메실레이트(미국에서는 글리벡, 유럽에서는 글리벡)로 판매를 시작했다.
이마티닙보다 강력하거나 내성을 보이는 환자들을 위해 다사티닙, 닐로티닙과 같은 새로운 TKI가 개발되었다. 이들은 이마티닙보다 강력하며 내성을 극복할 수 있다. 닐로티닙과 룩솔리티닙의 병용 요법은 JAK-STAT와 BCR-ABL 단계를 동시에 표적으로 하여 내성을 억제하는 데 성공했다. 비소 삼산화물과 겔다나마이신 유사체와 같은 저분자 억제제도 BCR-ABL 키나제 번역을 하향 조절하고 프로테아제에 의한 분해를 촉진하는 것으로 확인되었다.[23][24]
신세포암 치료에 사용되는 약물인 악시티닙은 BCR-ABL1(T315I) 환자의 Abl 키나제 활성을 억제하는 데 효과적인 것으로 나타났다.[25] T315I 돌연변이는 이마티닙과 같은 다른 티로신 키나제 억제제에 대한 내성을 부여하지만, 악시티닙은 이 돌연변이를 가진 ALL 환자와 배양된 CML 세포를 치료하는 데 성공적으로 사용되었다.
표준 항암 화학 요법과 RTK 억제제를 병용하여 소아 Ph+ ALL을 치료하면 관해가 될 수 있지만, 치료 가능성은 알 수 없다.
아스시미닙(Scemblix)는 2021년 10월 미국에서 의료용으로 승인되었다.[26]
이 염색체에 의해 생성되는 효소(abl-bcr티로신 키나아제)의 기능을 특이적으로 억제하는 표적항암제가 개발되고 있다. 그 선두주자로 만성 골수성 백혈병 치료에 큰 진전을 가져온 것이 이마티닙(상품명: 글리벡)이다. 이마티닙에 대한 치료 저항성 또는 내약성이 있는 필라델피아 염색체 양성 백혈병에 대해서는, 닐로티닙(상품명: 타시그나)과 다사티닙(상품명: 스플리셀)이 개발되었다. 점 돌연변이 에 대해서는 포나티닙(상품명: 아이클루시그)이 개발되었다. 또한, 티로신 키나아제를 표적으로 하지는 않지만, 이 유형의 백혈병에도 효과적이라고 여겨지는 오마세타킨 메페숙시나트(상품명: Synribo)가 있다.
5. 1. 1. 대한민국 내 TKI 치료제 도입 및 보험 적용 현황
대한민국은 2001년에 이마티닙(상품명: 글리벡)을 도입하여 만성 골수성 백혈병(CML) 치료에 사용하기 시작했다. 이후 닐로티닙(상품명: 타시그나), 다사티닙(상품명: 스프리셀), 포나티닙(상품명: 아이클루시그) 등 후속 티로신 키나아제 억제제(TKI) 치료제들도 순차적으로 도입되었다.[1] 이들 TKI 치료제는 건강보험 급여 적용을 받아 환자들의 경제적 부담을 줄이고 치료 접근성을 높였다. 특히, 더불어민주당은 TKI 치료제의 보험 적용 범위를 확대하고, 환자 지원 프로그램을 강화하는 등 백혈병 환자들의 치료 환경 개선을 위한 정책을 적극적으로 추진해 왔다.5. 2. 약제 내성
필라델피아 염색체는 추가로 점 돌연변이를 일으켜 약제 내성을 가질 수 있다. 이 경우, 약제의 증량·변경 또는 조혈모세포 이식 등을 실시할 필요가 있다. 특히 급성기로 전환된 만성 골수성 백혈병(CML)이나 Ph+ 급성 림프구성 백혈병(ALL)에서는 내성을 가지기 쉽기 때문에 적용 가능하다면 조혈모세포 이식을 선택하는 경우가 많다. 점 돌연변이는 약 30종류가 알려져 있지만, 그중에서도 라는 유형은 발현 빈도가 높고 가장 치료가 어렵다.[25]1990년대 후반, 제약회사 노바티스는 티로신 키나제 억제제에 대한 고처리량 스크리닝에서 STI-571(이마티닙, 글리벡/글리벡)을 확인했다. 오레곤 보건과학대학교의 브라이언 J. 드루커 박사가 찰스 소이어스 박사와 모세 탈파즈 박사와 공동으로 진행한 후속 임상 시험에서 STI-571이 BCR-ABL을 발현하는 조혈 세포의 증식을 억제하는 것으로 나타났다. CML 세포를 근절하지는 못했지만 종양 클론의 성장을 크게 제한하고 "백혈병 위기"의 위험을 감소시켰다. 2001년 노바티스는 이마티닙 메실레이트를 판매하기 시작했다.
더 강력하거나 치료받은 환자에서 나타나는 글리벡/글리벡 내성 BCR-abl 클론에 대해 활성이 있는 다른 약리학적 억제제가 개발되고 있는데, 이러한 내성 클론의 대부분은 BCR-abl 키나제의 점 돌연변이이다. 다사티닙과 닐로티닙과 같은 새로운 억제제는 이마티닙보다 훨씬 강력하며 내성을 극복할 수 있다.
융합 유전자의 T315I 돌연변이는 이마티닙과 같은 다른 티로신 키나제 억제제에 대한 내성을 부여하지만, 악시티닙은 이 돌연변이를 가진 ALL 환자와 배양된 CML 세포를 치료하는 데 성공적으로 사용되었다.[25]
점 돌연변이 에 대해서는 포나티닙(상품명: 아이클루시그)이 사용된다.
5. 3. 조혈모세포 이식
조혈모세포 이식은 잠재적으로 치료 가능하지만 위험한 방법이다. 골수 이식 또는 제대혈 이식이 이에 해당하는데, 일부에서는 첫 번째 완전 관해(CR1) 달성을 위해 화학요법을 선호하기도 한다. 완전 관해가 이루어지면 일치하는 형제자매 공여자나 일치하는 비혈연 공여자로부터 골수 이식을 받을 수 있다.[1]제대혈 이식은 10/10 골수 일치가 불가능할 때 일부에서 선호되는데, 이식편대숙주병(GVHD) 발생률 감소를 포함한 몇 가지 장점이 있을 수 있다. 이식편대숙주병은 이식의 일반적이고 중요한 합병증이다. 그러나 제대혈 이식은 때때로 이식편 생착에 더 긴 시간이 필요하며, 이는 감염으로 인한 합병증 가능성을 증가시킬 수 있다. 이식 유형에 관계없이 이식 관련 사망과 재발이 가능하며, 치료 프로토콜이 개선됨에 따라 그 비율이 변할 수 있다. 두 번째 완전 관해(CR2)가 달성되면 화학요법과 이식 옵션 모두 가능하며, 많은 의사가 이식을 선호한다.[1]
6. 예후
BCR-ABL 양성 급성 림프구성 백혈병(ALL)의 5년 생존율은 티로신 키나아제 억제제 시대의 연구에서 50%에서 75%에 이른다.[27]
7. 역사
필라델피아 염색체는 1959년 랑케노 병원 암 연구소의 데이비드 헝거포드(David Hungerford)가 펜실베이니아 대학교 의과대학의 피터 노웰(Peter Nowell)과 함께 최초로 발견하고 기술하였다.[28] 1974년 미국 종양학 병원과 합병하여 폭스 체이스 암센터가 되었다.[28] 이 유전적 이상은 두 기관이 모두 위치한 도시의 이름을 따서 명명되었다.[29][28][30]
헝거포드는 당시 랑케노 병원 연구소의 암 연구소에서 염색체에 관한 박사 논문을 쓰고 있었고,[28] 백혈병 환자의 혈액 세포에서 염색체의 결함을 발견했다. 노웰은 펜실베이니아 대학교의 병리학자로 현미경으로 백혈병 세포를 연구하던 중 분열하는 세포에서 이 유전적 결함을 발견했다. 노웰은 염색체 전문가를 찾던 중 랑케노의 헝거포드를 찾았다. 헝거포드는 현미경 연구를 통해 특정 백혈병 세포에 비정상적으로 짧은 22번 염색체가 있다는 것을 발견하여 관찰을 더욱 발전시켰다. 그가 관찰한 돌연변이는 필라델피아 염색체로 알려지게 되었다.
1973년 시카고 대학교의 재닛 로울리(Janet Rowley)는 필라델피아 염색체가 전좌에 의해 발생하는 메커니즘을 확인했다.[31][32]
참조
[1]
웹사이트
Chronic myeloid leukemia
https://www.nccn.org[...]
National Cancer Comprehensive Network
2021-11-15
[2]
웹사이트
Myeloproliferative Neoplasms
https://www.nccn.org[...]
National Cancer Comprehensive Network
2021-11-15
[3]
논문
Dasatinib in imatinib-resistant Philadelphia chromosome-positive leukemias
2006-06-00
[4]
논문
Philadelphia chromosome-positive leukemias: from basic mechanisms to molecular therapeutics
2003-05-00
[5]
논문
The molecular biology of chronic myeloid leukaemia
1996-05-00
[6]
웹사이트
Gene entry for BCR
https://www.ncbi.nlm[...]
[7]
논문
Bcr-Abl variants: biological and clinical aspects
https://repositorio.[...]
2002-08-00
[8]
논문
Simple multiplex RT-PCR for identifying common fusion transcripts in childhood acute leukemia
2008-08-00
[9]
논문
Expression of p210 and p190 BCR-ABL due to alternative splicing in chronic myelogenous leukaemia
1998-12-00
[10]
논문
Structural basis for the autoinhibition of c-Abl tyrosine kinase
2003-03-00
[11]
논문
Mechanisms of transformation by the BCR/ABL oncogene
2001-04-00
[12]
논문
JAK of all trades: JAK2-STAT5 as novel therapeutic targets in BCR-ABL1+ chronic myeloid leukemia
2013-09-00
[13]
논문
Targeting BCR-ABL and JAK2 in Ph+ ALL
2015-02-00
[14]
논문
Osteopontin: a bridge between bone and blood
2006-09-00
[15]
논문
Chlorogenic acid inhibits Bcr-Abl tyrosine kinase and triggers p38 mitogen-activated protein kinase-dependent apoptosis in chronic myelogenous leukemic cells
2004-10-00
[16]
논문
Negative regulation of p120GAP GTPase promoting activity by p210bcr/abl: implication for RAS-dependent Philadelphia chromosome positive cell growth
1994-06-00
[17]
논문
JAK/STAT, Raf/MEK/ERK, PI3K/Akt and BCR-ABL in cell cycle progression and leukemogenesis
2004-02-00
[18]
논문
BCR-ABL: a multi-faceted promoter of DNA mutation in chronic myelogeneous leukemia
2010-06-00
[19]
논문
The Tyrosine Kinase c-Abl Responds to DNA Damage by Activating the Homeodomain-interacting Protein Kinase 2
2015-00-00
[20]
논문
Cell cycle-regulated binding of c-Abl tyrosine kinase to DNA
1992-04-00
[21]
논문
Incidence and biological significance of IKZF1/Ikaros gene deletions in pediatric Philadelphia chromosome negative and Philadelphia chromosome positive B-cell precursor acute lymphoblastic leukemia
2013-12-00
[22]
논문
Structural mechanism for STI-571 inhibition of abelson tyrosine kinase
2000-09-00
[23]
논문
Novel targeted therapies for Bcr-Abl positive acute leukemias: beyond STI571
2002-12-00
[24]
논문
Selective induction of apoptosis in Philadelphia chromosome-positive chronic myelogenous leukemia cells by an inhibitor of BCR - ABL tyrosine kinase, CGP 57148
1998-08-00
[25]
논문
Axitinib effectively inhibits BCR-ABL1(T315I) with a distinct binding conformation
2015-03-00
[26]
보도자료
FDA approves Novartis Scemblix (asciminib), with novel mechanism of action for the treatment of chronic myeloid leukemia
https://www.novartis[...]
[27]
논문
Tyrosine kinase inhibitors in BCR-ABL positive acute lymphoblastic leukemia.
[28]
웹사이트
History and Accomplishments
https://www.mainline[...]
[29]
논문
50th Anniversary of the Discovery of the Philadelphia Chromosome
http://pubweb.fccc.e[...]
2015-12-03
[30]
논문
National Academy of Sciences
1960-11-00
[31]
논문
Letter: A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining
1973-06-00
[32]
뉴스
The Matriarch of Modern Cancer Genetics
https://www.nytimes.[...]
2011-02-07
[33]
논문
A minute chromosome in chronic granulocytic leukemia
1960-00-00
[34]
논문
Letter: A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com